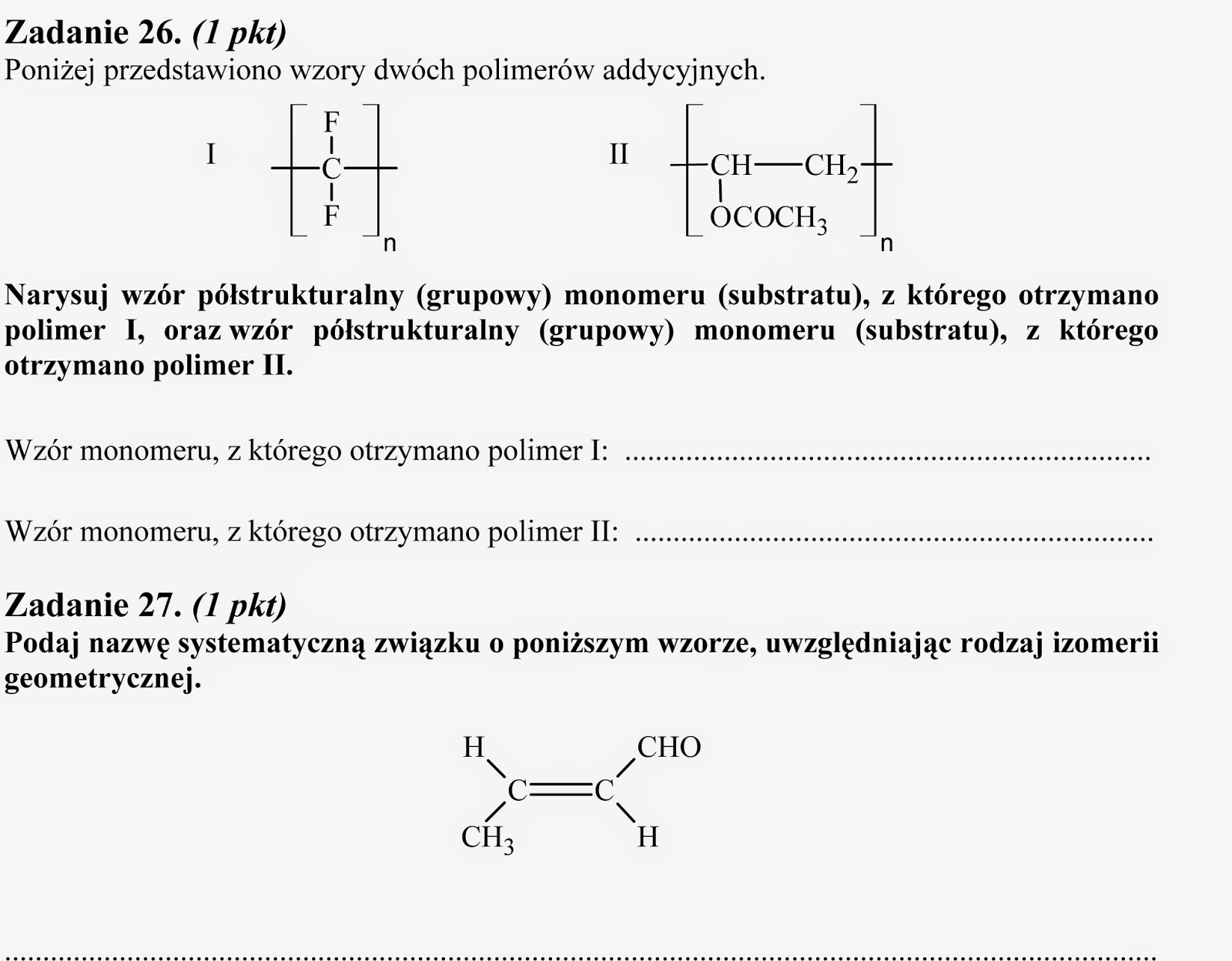
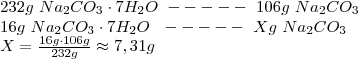Gazy charakteryzują się ściśliwością, czyli zmianą ciśnienia przy zmianie objętości.
Gdy gaz rozprężamy, zwiększamy objętość, gaz jest bardziej swobodny, to aby ogrzać pewną jego ilość o jeden stopień musimy dostarczyć więcej ciepła. Gdy zwiększamy ciśnienie (,,sprężanie''), to aby podwyższyć temperaturę o jeden stopień należy dostarczyć mniej ciepła. ściśnięty gaz łatwiej ogrzać.
Sprężanie - wzrost ciśnienia
Rozprężanie - spadek ciśnienia
Ciepło właściwe (c) - J/kg*K, ciepło potrzebne do zwiększenia temperatury ciała o
c= Q/m*ΔT
Q – dostarczone ciepło;
m – masa ciała;
ΔT – przyrost temperatury
Ciepło molowe (C) - J/mol*K, ciepło potrzebne do ogrzania 1 mola substancji o jeden stopień.
C= ΔQ/n*ΔT
C – molowe ciepło właściwe, (J /mol /K),
n – liczność (ilość substancji w molach)
Q – ciepło dostarczane do układu
Zad.1
W temperaturze 298K ciepło właściwe miedzi wynosi 0,386kJ.kg-1.K-1. Obliczyć ciepło molowe miedzi w tej temperaturze.
Ciepło właściwe miedzi wynosi 0,386kJ.kg-1.K-1 to, na ogrzanie 1kg miedzi o 1K potrzeba 0,386kJ ciepła. Aby ogrzać 63,54g miedzi należy dostarczyć ilość energii:
Zad. 3
W zakresie temperatur 300-325K średnie ciepło właściwe kobaltu wynosi 0,46kJ.kg-1.K-1. Ile ciepła należy dostarczyć, aby ogrzać kawałek kobaltu o masie 15g od temp. 300K do temp. 325K?
ΔT = 25K
na ogrzanie 1000g kobaltu o 1K potrzeba 0,46KJ
a o 25K - x x= 11,5KJ
1000g - 11,5Kj
15g - x
x= 0,1725 KJ
Zad 2
Ciepło molowe oznacza, że na ogrzanie 143,33g AgCl o 1K potrzeba 50,83J energii na sposób ciepła. Ile energii potrzeba na ogrzanie 1kg AgCl o 1K?
0,5083 KJ - 143,33g ACl ( 1mol)
x - 1000g (1kg) x= 3,546KJ= 354,6 J
Termochemia - sposób rozwiązywania zadań.
Mój własny sposób na zadania z termochemii jest taki, że po prostu robię metodę sumowania, gdy odwracam równania na drugą stronę, to zmieniam znak, mnożę odpowiednio kiedy trzeba i według mnie to jest najlepszy sposób. Pamiętam również, że przy obliczaniu entalpii a podstawie energii wiązań odejmuje od entalpii substratów entalpię produktów.
Co jeszcze trzeba wiedzieć?
Wyobraź sobie, że entalpia H określa Ciebie, twój wewnętrzny poziom energii, a Q ciepło określa otoczenie. Dla reakcji egzoenergetycznych entalpia ma znak ujemny, tzn. Ty straciłeś energię, ale skoro Ty straciłeś to otoczenie ja zyskało (nic w przyrodzie nie ginie :) ), zatem Q dla reakcji egzoenergetycznych ma znak przeciwny, niż entalpia. Tak samo z reakcją endo. - Ty zyskałeś energię, ale układ stracił.
Gdy w treści mamy podane, że reakcji towarzyszy wydzielenie ciepła (ciepło wydziela się z układu do otoczenia) to Q ma znak dodatni, a entalpia jest tą samą wartością ze znakiem przeciwnym.
Gdy piszą, że x ciepła się wydzieliło lub dostarczono , to wyraźnie widać, że mamy podane Q.
Dla przykładu:
Oblicz zmianę entalpii reakcji syntezy amoniaku w przeliczeniu a 1mol produktu, jeśli otrzymanie 3,4kg amoniaku wiąże się z wydzieleniem 9188kJ ciepła.
Q= 9188kJ
ΔH = - 9188kJ
M= 17g/mol
n=200moli
200 moli - 9188 kJ
1 mol - x
x= 45,94 kJ tyle ciepła się wydzieli
a mamy obliczyć zmianę etalpii:
ΔHNH3 = - 45,94kJ
Kolejny haczyk : ,,Oblicz efekt energetyczny lub oblicz efekt cieplny'' - tu pytają nas o entalpię, entalpię można również nazwać ciepłem spalania ( ilość energii oddawanej do otoczenia na sposób ciepła w czasie spalania określonej ilości substancji w ustalonych warunkach), ciepłem tworzenia (entalpia tworzenia), ciepłem przemiany.
Na podstawie ciepeł spalania i tworzenia możemy wyliczyć entalpię reakcji.
Reakcja rozkładu tego samego związku będzie miała znak przeciwny, niż reakcja tworzenia.
Mam nadzieję, że teraz już zrozumiecie każde zadanie :).
Wpadło mi takie zadanie z ogniw:
Podczas pracy ogniwa srebrowo-cynkowego masa elektrody srebrowej zmieniła się o 1,512g. Oblicz, jak i o ile zmieniła się masa drugiej elektrody w tym czasie.
Anoda : Zn = Zn²⁺ + 2e
Katoda : 2Ag⁺ = 2Ag - 2e⁺
M Zn= 65,4g/mol
M Ag = 108g/mol
z równań wynika że przy roztworzeniu 1 mola Zn na katodzie wydzieli się 2 mole Ag
jeżeli masa elektrody srebrowej wzrośnie o 216g(2 mole) to masa elektrody cynkowej zmaleje o 65,4g
216g - 65,4g
1,512g - X
X=0,4578g otyle zmaleje masa elektrody cynkowej
Zad. 24
Sierpień 2010


-11.jpg)