Ogniwa galwaniczne
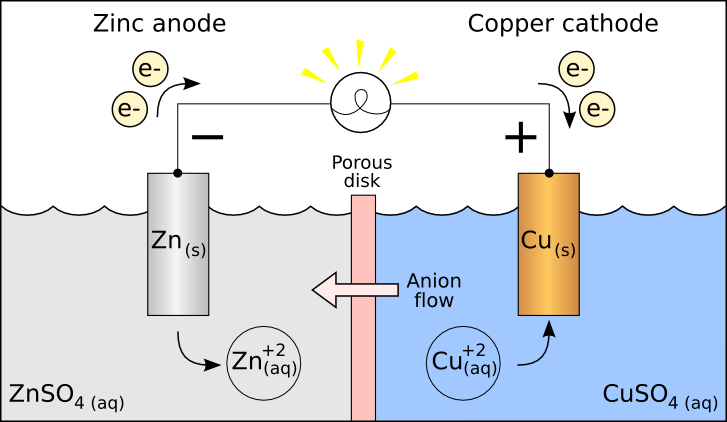
Ogniwo - układ dwóch blaszek metalowych zanurzonych w roztworze elektrolitu. Ogniwo składa się z dwóch półogniw, które stanowi przewodnik metaliczny (elektroda) zanurzony w roztworze elektrolitu.
W wyniku reakcji chemicznych w ogniwach płynie prąd.
Przewodnik zewnętrzny - łączy półogniwa, umożliwia zachodzenie reakcji redoks w obu półogniwach, gdyż umożliwia przepływ elektronów ( a tym samym prądu elektrycznego).
Klucz elektrolityczny - łączy roztwory zapewniając przepływ jonów między nimi, umożliwia wyrównywanie stężeń w roztworach. Klucz stanowi wygięta rurka, wypełniona najczęściej KCl, zanurzona w roztworach półogniw.
Katoda - elektroda dodatnia, stanowi ją pierwiastek o wyższym potencjale (wartość odczytujemy z tablic potencjałów elektrodowych). Na katodzie zawsze (także w elektrolizie) zachodzi redukcja.
Anoda - elektroda ujemna, o niższym potencjale. Na niej zawsze zachodzi redukcja.
Zgodnie z konwekcją sztokholmską zapisujemy od lewej schemat półogniwa anodowego,a po prawej katodowego.
Zapamiętaj!
Elektrony przepływają zewnętrznym przewodnikiem (a nie kluczem!), ruch elektronów w ogniwach odbywa się w kierunku od anody (-) do katody (+) *zwróć uwagę na znaki poszczególnych półogniw, w elektrolizie mamy na odwrót. Elektrony płyną od anody, bo ona oddaje elektrony i się utlenia, do katody która się redukuje i je przyjmuje. Natomiast prąd wywołany ruchem elektronów płynie w przeciwnym kierunku tj. od katody do anody ( na katodzie potencjał jest wyższy i prąd płynie od potencjału wyższego do niższego, od dodatniego bieguna do ujemnego).
Rodzaje elektrod:
- obojętne - (półogniwa redoks) nie reagujące, udział biorą wyłącznie jony z roztworu (składniki elektrolitu). Elektroda odgrywa rolę jedynie przekaźnika elektronów. Jako elektrod używa się blaszek z metalu szlachetnego niebiorącego udziału w procesie elektrodowym np. platyny lub grafit.
Ag|AgCl|Cl-
AgCl +1e- ---> Ag (s) + Cl- (aq)
lub półogniwo gazowe - udział biorą substancje gazowe np. wodorowe.
- reagujące - (półogniwa I rodzaju) np. miedziane, niklowe w niklu, elektrody biorą udział w reakcji redoks.
Przykłady ogniw:
- ogniwo Daniella - klasyka
Obserwacje:
Płytka cynkowa rozpuszcza się.
Elektroda miedziowa pokrywa się rdzawym osadem.
Równania:
Opis:
Na anodzie cynkowej jony Zn2+ przechodzą do roztworu, płytka rozpuszcza się. elektrony wędrują od anody do katody i redukują Cu2+ w roztworze, zatem Cu osadza się na płytce. Przez klucz elektrolityczny jony SO42- wędrują do anody w celu wyrównania różnicy ładunków. Prąd płynie od katody (wyższy potencjał) do anody (niższy potencjał). ogniwo pracuje do momentu, aż wszystkie jony Cu2+ w roztworze się zredukują lub wszystkie atomy cynku na blaszce się utlenią.
- Ogniwo Volty - elektrody zanurzone w elektrolitach własnej soli
Obserwacje:
Płytka cynkowa rozpuszcza się .
Na elektrodzie miedzianej wydzielaja się pęcherzyki gazu.
Miedź nie reaguje z rozcieńczonym H2SO4 jakiego użyto w tym ogniwie.
Równania:
Jony SO42- stanowią przeciwjony dla H+ i Zn2+, jako tako nie uczestniczą w całym procesie redoks.
- Ogniwo wodorowo-tlenowe (ogniwa paliwowe) - powstaje woda, bierze udział H2 i O2.
- anoda (-) 2H2 → 4H+ + 4e−
- katoda (+) O2 + 4e− → 2O2−
- 2O2− + 4H+ → 2H2O
- Ogniwo stężeniowe - zbudowane z dwóch jednakowych elementów metalicznych,
zanurzonych w roztworach z jonami o różnych stężeniach. Takie ogniwo pracuje do momentu wyrównania stężeń.
(-) Ag|AgNO3||AgNO3|Ag (+)
C1<C2
Anoda (-): Ag--> Ag+ + 1e-
Katoda(+): Ag+ + 1e- --->Ag
Ag+Ag+ ---> Ag+ + Ag
(c2) (c1)
Czyli po lewej i po prawej musi być takie samo stężenie jonów srebra.
- Ogniwo wodorowo-chlorowe
(-) Pt|H2|H+,Cl-|Cl2|Pt (+)
A: H2---> 2H+ +2e-
K: Cl2+2e- --->2Cl-
H2+Cl2--->2H+ + 2Cl-
Akumulatory - w czasie ich pracy pobierany jest z nich prąd, są ogniwami, które po wyczerpaniu substratów mogą być ponownie naładowane. Aby to zrobić należy przepuścić prąd przez roztwór elektrolityczny. Wyróżniamy akumulatory kwasowe ( z kwasem) i zasadowe ( z zasadą).
W akumulatorach proces rozładowania i ładowania są przeciwstawne (reakcje zapisujemy z dwoma strzałkami). Sumaryczna ilość elektronów oddanych i pobranych musi nam się zgadzać w reakcjach połówkowych, po zbilansowaniu możemy ułożyć równanie sumaryczne. Podczas pracy akumulatora SEM obniża się, gdy napięcie spadnie do pewnej granicy należy naładować akumulator, aby nie dopuścić do jego uszkodzenia. Podczas ładowania akumulatora katoda staje się anodą, a anoda katodą.
SEM - siła elektromotoryczna, warunkuje przepływ prądu w obwodzie. Jest różnicą potencjałów panujących na katodzie i anodzie. SEM jest zawsze wartością dodatnią.
SEM= Ek - EA
*****************************************************************************
Elektroliza
Elektroliza wodnych roztworów elektrolitów
Jeśli podłączymy źródło prądu stałego do elektrod lub do innego przewodnika jonowego np. stopionych soli, to wówczas zajdą procesy odwrotne do tych jak w ogniwach i pod wpływem prądu stałego nastąpi szereg przemian chemicznych - zajdzie elektroliza.
W elektrolizerze odwrotnie, niż w ogniwach elektroda dodatnia zwana jest tu anodą i połączona jest z dodatnim źródłem napięcia (+), a katoda tu elektroda ujemna z ujemnym (-). Ale zasada zostaje: na anodzie utlenianie, na katodzie redukcja.
Anoda (+)
Katoda (-)
Reguły:
Katoda
1.Najpierw redukują się kationy metali mniej aktywnych od glinu,a na katodzie wydziela się metal.
2. Po metalach mniej aktywnych od glinu redukują się jony H+ lub cząsteczki H2O, w zależności od środowiska na katodzie wydziela się wodór
- w roztworach kwasów
2H+ + 2e- -----> H2
- w wodnych roztworach soli litowców i berylowców lub glinu
2H2O +2e- ----> H2 + 2OH-
Anoda
1. Najpierw utleniają się aniony kwasów beztlenowych i ich soli, na anodzie wydziela się gazowy niemetal.
2. Następnie utleniają się jony OH- lub cząsteczki H2O w zależności od środowiska, na anodzie wydziela się tlen.
-w roztworach wodorotlenków metali
4OH- -----> 2H2O + O2 + 4e-
-w roztworach kwasów tlenowych i ich soli
2H2O ---> O2 + 4H+ + 4e-
*****************************************************************************
To teraz na rozgrzewkę kilka zadań z ogniw i elektrolizy :)
Matura maj 2013
Zad.16
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. akumulator kwasowo-ołowiowy.
| Równanie reakcji elektrodowej | Potencjał standardowy |
| PbSO4 + 2e - ⇄ Pb + SO42- | E°= ‒ 0,36 V |
| PbO2 + 4H+ + SO42- + 2e ⇄ PbSO4 + 2H2O | E°= + 1,69 V |
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Korzystając z podanych informacji, napisz sumaryczne równanie reakcji, która zachodzi w pracującym akumulatorze kwasowo-ołowiowym, oraz oblicz siłę elektromotoryczną (SEM) tego ogniwa w warunkach standardowych.Odp.
Równanie reakcji: Pb + 2SO42- + PbO2 + 4H+ › 2PbSO4 + 2H2O
SEM: 2,05V
Najpierw ustalamy które ogniwo stanowi katodę, a które anodę. W treści piszą,że ogniwo jest pracujące tzn. następuje wyładowanie.Układamy równania połówkowe zgodnie z kierunkiem anoda- utlenianie, a katoda - redukcja, sprawdzamy ilość elektronów oddanych i pobranych. Zapisujemy równanie sumaryczne.
Matura maj 2013
Zad.17
c) Napisz równania reakcji elektrodowych zachodzących w czasie elektrolizy stopionego wodorku litu, wiedząc, że na anodzie wydziela się wodór.
Równanie reakcji katodowej: 2Li+ + 2e → 2Li
Równanie reakcji anodowej: 2H- → H2 + 2e
Matura maj 2012
Zad.22
W 1 dm3 wody rozpuszczono azotan(V) srebra(I) AgNO3, azotan(V) miedzi(II) Cu(NO3)2 oraz azotan(V) sodu NaNO3, otrzymując roztwór o jednakowych stężeniach molowych kationów. Przez otrzymany roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech pierwiastków.
a) Uzupełnij poniższą tabelę, wpisując nazwy lub symbole pierwiastków w kolejności ich wydzielania na katodzie.
Kolejność wydzielania na katodzie: I II III Nazwa pierwiastka: srebro miedź wodór
Patrzymy na szereg potencjałów standardowych. Najpierw na katodzie wydzieli się pierwiastek o najwyższym potencjale ( chętniej ulegnie redukcji).
b) Wiedząc, że w doświadczeniu użyto elektrod grafitowych, określ, jaki pierwiastek wydzielił się na anodzie. Odpowiedź uzasadnij, pisząc równanie reakcji anodowej.
Nazwa lub symbol pierwiastka: tlen Równanie reakcji: 2H20 --> 4H+ + O2 + 4e-
Podczas elektrolizy wodnego roztworu soli kwasów tlenowych na anodzie wydziela się tlen (ulega utlenieniu).
Matura maj 2012
Zadanie 23
Zaprojektuj ogniwo galwaniczne, w którym półogniwo Ni│Ni2+ będzie pełnić funkcję anody.
a) Uzupełnij poniższy schemat, wpisując symbole lub wzory odczynników wybranych
spośród następujących:
Ni Ni(NO3)2 (aq) Pb Pb(NO3)2 (aq) Zn Zn(NO3)2 (aq)
anoda (-) katoda (+)
NI Pb
Ni(NO3)2 Pb(NO3)2
b) Opisz zmiany, jakie będzie można zaobserwować w półogniwach podczas pracy
ogniwa.
Anoda: płytka roztwarza się (płytka rozpuszcza się)
Katoda: na płytce pojawia się osad ołowiu (płytka zwiększa swoją masę)
Matura maj 2011
Zadanie 17
W celu oczyszczenia miedzi prowadzi się elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) na elektrodach, z których jedną stanowi czysta miedź, a drugą miedź zanieczyszczona. Podczas tego procesu miedź i metale o niższym standardowym potencjale redukcji niż miedź ulegają na anodzie utlenieniu, natomiast na katodzie osadza się czysta miedź.
Płyta miedziana zawierająca ok. 98% miedzi zanieczyszczona jest niklem. W celu uzyskania czystej miedzi płytę poddano elektrorafinacji.
Korzystając z powyżej informacji, napisz równania wszystkich reakcji, zachodzących na elektrodach podczas elektrorafinacji.
Procesy elektrodowe:
A (+) Cu › Cu2+ + 2e
A(+) Ni › Ni2+ + 2e
K(-) Cu2+ + 2e › Cu
Z treści wnioskujemy, że podczas elektrolizy roztworzeniu ulega anoda, w skład której wchodzi miedź zanieczyszczona niklem. Metale te utleniają się, natomiast na katodzie osadza się czysta miedź.
Zadania do których warto zerknąć:
Witowski próbna kwiecień 2013 arkusz II zad. 4
Witowski luty 2008 arkusz II zad. 8 i 10
Witowski 2009 marzec arkusz II zad. 6 i 10
Witowski 2010 marzec arkusz II zad. 19
Witowski 2011 marzec arkusz II zad. 8 i 11